本ニュースリリースは、協和キリンと米国MEI Pharma, Inc.が5月19日(米国東海岸時間:日本時間5月20日)に発表した英文プレスリリースの内容を、協和キリンが日本語に翻訳、再構成し、発表しています。本ニュースリリースの正式言語は英語であり、その内容・解釈については英語が優先しますことをご留意下さい。 協和キリン 英語リリース![]()
Zandelisibの新規臨床試験データに関するASCO(米国臨床腫瘍学会)2021年会での発表について
- 予後不良とされているPOD24(初発治療開始後24カ月以内の疾患進行)に該当する、再発または難治性の濾胞性リンパ腫症例において全奏効率82%、安全性に関して大きな懸念無し
- 低悪性度B細胞悪性腫瘍症例において、BTK阻害剤との併用で単剤と比較して付加的な毒性を示すことなく奏効率100%を示した
- 第3相COASTAL試験に関してデザイン詳細の紹介
協和キリン株式会社(本社:東京、代表取締役社長:宮本 昌志、以下「協和キリン」)とMEI Pharma, Inc. (本社:米国サンディエゴ、社長兼CEO:Daniel Gold 、以下「MEI」)は、B細胞悪性腫瘍を対象として現在開発中のホスファチジルイノシトール-3キナーゼデルタ(PI3Kδ)阻害剤zandelisibの第1b相臨床試験で得られた最新のデータ、および第3相COASTAL試験のデザインについて、オンライン開催されるASCO(米国臨床腫瘍学会)2021(6月4日~8日)でポスター発表することをお知らせします。
MEIのチーフメディカルオフィサーRichard Ghalie医学博士は次のように述べています。「今年のASCO年会で発表されるzandelisibのデータ、特にPOD24と呼ばれる、予後が悪く、第3相COASTAL試験への組み入れ基準を満たすと考えられる患者さんに対してのデータは、我々を非常に勇気づけるものです。加えて、zandelisibとBTK阻害薬zanubrutinibの併用療法に関するデータでは、様々なB細胞悪性腫瘍に対して持続的な効果をしっかり発揮できる可能性が示されるとともに、良好な忍容性も示されました。今年末には第2相TIDAL試験に関するトップラインデータを報告できる予定でもありますので、グローバルパートナーである協和キリンと協力しながら、B細胞悪性腫瘍の患者さんに単剤または他剤併用でベストインクラスの治療選択肢を提供するべく、zandelisibの開発プログラムに引き続き取り組んでまいります。」
本学会では、次に示す3つの演題を発表予定です。
- 再発または難治性の濾胞性リンパ腫(FL)症例を対象とした、zandelisibの第1b相臨床試験の新規データ
- FL症例の予後不良因子である、初発治療開始後24カ月以内に病勢が進行した(POD24)再発または難治性のFL症例においてもzandelisibの忍容性は良好であり、全奏功率は82%を示しました。また非POD24症例の全奏効率は93%でした。これらを合わせた再発または難治性のFL症例全37例の奏効率は87%でした。
- 再発または難治性のB細胞悪性腫瘍症例を対象とした、zandelisibとzanubrutinibの併用による第1b相臨床試験の新規データ
- 再発または難治性のB細胞悪性腫瘍症例を対象に、BeiGene社が開発したブルトン型チロシンキナーゼ阻害剤であるzanubrutinib(販売名:BRUKINSA®)とzandelisibの併用効果を検討している第1b相試験の新規データです。安全性評価対象となった20例に対して、zandelisibとzanubrutinibの併用療法の忍容性は概ね良好でした。また、最適化された用量で投与された本併用療法では、各薬剤単剤の場合と比較して、新たな毒性や毒性発現率の上昇は認められませんでした。さらに、再発または難治性の低悪性度B細胞悪性腫瘍および慢性リンパ性白血病(CLL)症例(16例)の客観的奏効率は100%でした。
- 再発または難治性の低悪性度非ホジキンリンパ腫症例を対象とした、zandelisibとリツキシマブの併用による第3相COASTAL試験のデザイン
-
COASTAL試験は、再発・難治性の低悪性度非ホジキンリンパ腫症例を対象にzandelisibとリツキシマブの併用療法を評価する第3相試験です。COASTAL試験は少なくとも1回以上の前治療歴のある再発または難治性のFLまたは辺縁帯リンパ腫(MZL)症例を対象とした、zandelisibの米国での迅速承認時に要求される検証的試験として実施予定です。また本試験はFDA(米国食品医薬品局)による追加適応症の承認、および世界各国での販売承認申請をサポートする役割も備えています。
協和キリンの執行役員 研究開発本部長 鳥居義史は、「第1相試験から、zandelisibは血液がんの増殖と生存に重要な役割を担うPI3Kδアイソフォームに対する高い選択性に加え、持続的な薬効を示すことが示唆されました。ユニークな特性を有するこのzandelisibについて、我々はMEIファーマ社と協力して継続して開発に取り組んでいきたいと考えています。さらなるデータをもとに本化合物の理解を深め、B細胞悪性腫瘍の患者さんに新たな選択肢を提供できることを願っています。」と述べています。
- 再発または難治性のFL症例を対象とした、zandelisibの第1b相臨床試験の最新データ
-
- ポスタータイトル: Efficacy and Safety of the PI3Kδ Inhibitor Zandelisib (ME-401) on an Intermittent Schedule (IS) in Patients with Relapsed/Refractory Follicular Lymphoma (FL) with Progression of Disease within 24 Months of First-Line Chemoimmunotherapy (POD24)
- 日本時間6月4日22時よりこちら
 でオンデマンドビューイング可能
でオンデマンドビューイング可能 - ポスターはMEIウェブサイト
 でも公開
でも公開
本ポスターの筆頭著者の、スウェーデンがんセンターの血液悪性腫瘍部長であるJohn Pagel医学博士は次のように述べています。「再発または難治性のFL患者さんのうち、初回治療開始後24ヶ月以内に病勢が進行したグループは、24ヶ月以降に再発したFL患者さんに比べて予後が悪く、新たな治療選択肢のニーズが高い領域です。この良好な結果は、zandelisibが再発または難治性のFLのリスクの高い患者さんに、新たな治療選択肢を提供できる可能性を示しています。」
- 試験詳細
-
現在実施中の第1b相臨床試験は、再発または難治性のB細胞悪性腫瘍症例を対象にzandelisibの単剤および他剤との併用効果を評価する、多施設非盲検の用量最適化試験です。本日発表されたデータは、28日間を1サイクルとして、zandelisib 60mgを1日1回2サイクル投与し、それ以降は28日サイクルの最初の7日間のみ1日1回の投与を行う間歇投与スケジュール(IS)で投与された症例に関するものです。これまでに37名の再発または難治性のFL症例に、zandelisibの単剤またはリツキシマブとの併用による間歇投与を行いました。37名の再発または難治性のFL症例のうち、22名がPOD24でした。
再発または難治性のFL症例37名の全奏効率は87%で、27%が完全奏効を達成しました。POD24症例の全奏効率は82%、非POD24症例では93%でした。POD24症例の完全奏効率は18%、非POD24症例では40%でした。
- Overall Response Rate
-
この表はスクロールしてご覧いただけます
All
(N = 37)POD24
(n = 22)Non-POD24
(n = 15)ORR, n (%)※ 32 (87) 18 (82) 14 (93) Monotherapy, n/N (%)
Combination with rituximab, n/N (%)14/18 (78)
18/19 (95)8/11 (73)
10/11 (91)6/7 (86)
8/8 (100)Prior lines of therapy, n/N (%)
1 line of prior therapy
≥ 2 lines of prior therapy14/16 (88)
18/21 (86)5/7 (71)
13/15 (87)9/9 (100)
5/6 (83)CR rate, n (%) 10 (27) 4 (18) 6 (40) - ※Imaging scans were obtained after 2 and 6 cycles, and then every 6 cycles. Response was reported based on Lugano criteria.
- criteria.
ORR: 全奏効率、CR: 完全奏効
- 奏効期間
POD24症例におけるフォローアップ期間※の中央値は15.8カ月(範囲:5.6~33.1)、非POD24症例では17カ月(範囲:1.2~28.6)であり、いずれも奏効期間の中央値にはまだ達していませんでした。
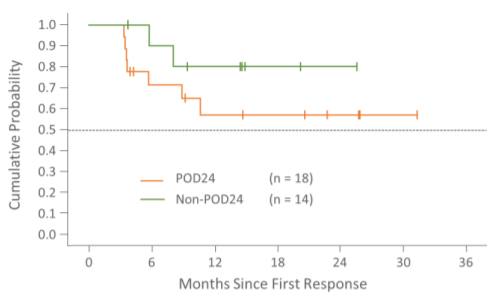 ※フォローアップ期間 = 最初の反応から治療中止日までの期間、進行中の症例の場合はデータカットオフ(2020年12月10日)までの期間
※フォローアップ期間 = 最初の反応から治療中止日までの期間、進行中の症例の場合はデータカットオフ(2020年12月10日)までの期間
- 無増悪生存期間
POD24症例の無増悪生存期間の中央値は12.5カ月で、非POD24群では中央値に達していませんでした。POD24群と非POD24群のフォローアップ期間※の中央値は、それぞれ19.4カ月(範囲:1.8~36.5)、18.2カ月(範囲:3.0~30.4)です。
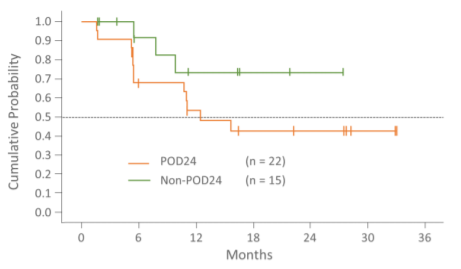 ※フォローアップ期間 = 試験開始日から治療中止日またはデータカットオフ(2020年12月10日)までの期間
※フォローアップ期間 = 試験開始日から治療中止日またはデータカットオフ(2020年12月10日)までの期間
- 有害事象
Zandelisibの忍容性は概ね良好であり、POD24症例と非POD24症例の間に有害事象の差は認められませんでした。有害事象による中止率は8%(n=3)、グレード3以上の有害事象の発生率は以下の通りです。
この表はスクロールしてご覧いただけます
Grade ≥3 Adverse Events in ≥2 Patients N = 37
N (%)Neutropenia 6 (16) ALT/AST increased 3 (8) Rash 3 (8) Diarrhea 2 (5) Colitis 2 (5) Hypokalemia 2 (5) Hyponatremia 2 (5) Coronavirus infection 2 (5)
- 再発または難治性のB細胞悪性腫瘍症例に対するzandelisibとzanubrutinibの併用による第1b相臨床試験の新規データ
-
- ポスター題名: Initial Results of the Combination of PI3Kδ Inhibitor Zandelisib (ME-401) and the BTK Inhibitor Zanubrutinib in Patients (pts) with r/r B-cell Malignancies
- 日本時間6月4日22時よりこちら
 でオンデマンドビューイング可能
でオンデマンドビューイング可能 - ポスターはMEIウェブサイト
 でも公開
でも公開
本ポスターの筆頭著者のハーバード・メディカル・スクールおよびマサチューセッツ総合病院がんセンターの助教授であるJacob Soumerai医学博士は次のように述べています。「本日報告されたzandelisibとzanubrutinibの併用療法のデータは、安全性および有効性の両面で有望であり、この経口剤の併用療法を様々なB細胞悪性腫瘍に拡大して評価することを後押しするものです。」
- 試験詳細
-
現在実施中の第1b相臨床試験は、多施設共同、非盲検の用量最適化試験で、再発または難治性のB細胞悪性腫瘍症例を対象に、zandelisibの単剤投与および他剤併用による治療効果を評価しています。本日発表されたデータはzandelisibとzanubrutinibを併用した20例のものであり、以下に示す2つの治療法の投与レジメンが検討されました。
Group A:zandelisib 60mgを1日1回、8週間継続投与した後、28日サイクルの1~7日目に投与し、zanubrutinibについては160mgを1日2回投与。
Group B:1サイクル目から28日サイクルの1~7日目にzandelisib 60mgを1日1回投与し、zanubrutinib 80mgを1日2回投与。
Group AではFL 1名、CLL 3名、MZL 1名、マントル細胞リンパ腫(MCL)1名、びまん性大細胞型B細胞リンパ腫/高悪性度B細胞リンパ腫(DLBCL/HGBCL)1名、計7名が参加しました。Group BではFL 7名、CLL 2名、MZL 1名、DLBCL/HGBCL 3名、計13名の症例が登録されました。本治療は、病勢の進行、不忍容、もしくは同意が撤回されるまで継続されました。
- 全奏効率
-
再発または難治性の低悪性度B細胞悪性腫瘍、およびCLLの評価可能な全症例における全奏効率は100%でした。DLBCL/HGBCLの2例では奏効が認められませんでした。腫瘍縮小効果は持続的であり、中央値で6.6カ月(0.6~21.3)のフォローアップ期間を経て、奏効が得られた症例の大半は現在も治療を継続しています。
この表はスクロールしてご覧いただけます
Evaluable
n = 18FL
(n = 8)CLL/SLL
(n = 5)MZL
(n = 2)MCL
(n = 1)DLBCL/HGBCL
(n = 2)ORR※, n (%) 8 (100) 5 (100) 2 (100) 1 (100) 0 Group A 1 (100) 3 (100) 1 (100) 1 (100) 0 Group B 7 (100) 2 (100) 1 (100) 0 0 - ※CR/CRi in 2/8 FL (25%) and 2/5 CLL (40%). Imaging scans at month 3, 7, 13, and then every 6 months until progression. Response reported based on Lugano criteria and iwCLL. 2/20 patients (1 DLBCL, 1 HGBCL) did not have on-therapy scans: 1 had clinical PD and 1 had AE due to prior therapy and discontinued early. Median follow-up time was 6.6 months for all patients (range 0.6─21.3), 3.6 months for Group A (range 0.6─21.3), and 6.6 months for Group B (range 1.9─14.1).
- 有害事象
-
Zandelisibを1サイクル目から各サイクルの1~7日目のみに60mgを1日1回経口投与し、これにzanubrutinib 80mgの1日2回経口投与を併用するGroup Bのレジメンを検討したところ、多様なB細胞悪性腫瘍で良好な忍容性が示されました。また各薬剤単独の場合と比較して、新たな毒性は認められませんでした。Group BでAST/ALTがグレード3に上昇した2名の症例のうち1例は治療を再開、継続しています。
この表はスクロールしてご覧いただけます
Group A
(n = 7)Group B
(n = 13)Adverse Event, n (%) All Grades Grade ≥ 3 All Grades Grade ≥ 3 Neutropenia 4 (57) ※3 (43) 6 (46) 3 (23) ALT increased 2 (29) 2 (29) 2 (15) ※※2 (15) AST increased 2 (29) 2 (29) 3 (23) ※※2 (15) Anemia 1 (14) ※1 (14) 2 (15) 1 (8) Hyperkalemia 2 (29) 0 2 (15) 1 (8) Thrombocytopenia 4 (57) ※2 (29) 3 (23) 1 (8) Pleural Effusion 2 (29) ※1 (14) 0 0 Rash 1 (14) 1 (14) 2 (15) 0 Appendicitis 0 0 1 (8) 1 (8) Ascites 1 (14) ※1 (14) 0 0 CMV colitis 1 (14) 1 (14) 0 0 Fatigue 4 (57) 1 (14) 2 (15) 0 Pneumonia 2 (29) ※1 (14) 0 0 Tumor lysis syndrome 0 0 1 (8) 1 (8) Diarrhea 3 (43) 0 3 (23) 0 Atrial fibrillation 1 (14) 0 0 0 - ※Group A: 1 DLBCL patient experienced Grade 3 AE on Day 0 attributed to prior therapy and discontinued treatment on Day 17, then progressed on Day 23 and died with Grade 4 thrombocytopenia and pleural effusion, Grade 3 pneumonia, anemia, and ascites.
- ※※Group B: DLT.
この第1b相試験では、再発または難治性のFLおよびMCLを対象とした拡大コホートの登録が継続中であり、zandelisib 60mgを1サイクル目から1~7日目に投与し、zanubrutinib 80mg(1日2回投与)と併用した際の薬効を評価中です。
- 低悪性度非ホジキンリンパ腫症例を対象とした、zandelisibとリツキシマブの併用による第3相COASTAL試験のデザイン
-
- ポスター題名: Coastal: A phase 3 study of the PI3Kδ inhibitor zandelisib with rituximab ® versus immunochemotherapy in patients with relapsed indolent non-Hodgkin’s lymphoma (iNHL)
- 日本時間6月4日22時よりこちら
 でオンデマンドビューイング可能
でオンデマンドビューイング可能 - ポスターはMEIウェブサイト
 でも公開
でも公開
本試験は、zandelisibとリツキシマブの併用療法と、標準化学療法とリツキシマブの併用療法を比較する国際共同、ランダム化、非盲検第3相試験で、534例が登録される予定です。28日間を1サイクルとして、zandelisib 60mgを1日1回2サイクル投与し、それ以降は28日サイクルの最初の7日間のみ1日1回の投与を行うISで実施されます。
ポーランド、クラクフのMaria Sklodowska-Curie国立腫瘍学研究所の臨床腫瘍学部門のWojciech Jurczak教授(M.D., Ph.D)は、次のように述べています。「zandelisibは、PI3Kδアイソフォームに対して高い選択性を示す強力な阻害剤として、他とは差別化された治療プロファイルを有しているため、単剤および他剤併用の両方において、さまざまなB細胞悪性腫瘍に対する治療効果を評価するための理想的な候補化合物と言えます。COASTAL試験の開始は、ユニークな投与スケジュールで最適化されたベストインクラスのPI3Kδ阻害剤としてのzandelisibの可能性を評価する上で、重要なマイルストーンとなるでしょう。」
Zandelisibの単剤及び他剤併用の臨床試験結果は、本剤のB細胞悪性腫瘍を対象とした臨床開発を下支えするものです。臨床試験では、zandelisibを単剤またはリツキシマブとの併用で、再発または難治性のFLおよびMZLにおいて間歇投与(最初の2サイクルは連日投与し、それ以降のサイクルは最初の7日間のみ投与)を行った結果、83~89%の奏効率を達成し、現時点で奏効期間の中央値には達していません。Zandelisibを単剤または併用で投与した症例では、前治療歴や腫瘍の大きさにかかわらず、持続的な腫瘍縮小効果が得られています。また、最適化されたzandelisibの投与スケジュールでは、B細胞悪性腫瘍症例において、PI3Kδ阻害剤に由来するグレード3以上の免疫関連有害事象の発現割合は10%未満でした。Zandelisibは現在、再発または難治性のFLまたはMZL症例を対象に、単剤療法として第2相TIDAL試験を実施しています。COASTAL試験の症例登録は、2021年半ば頃に開始される予定です。
- Zandelisibについて
-
Zandelisib(開発番号:ME-401)は、B細胞悪性腫瘍を対象とした、1日1回経口投与する治療薬として現在開発中の選択的PI3Kδ阻害剤です。米国食品医薬局(FDA)は、少なくとも2回の全身治療を受けた再発または難治性のFLの成人症例を対象に、2020年3月に本剤をファスト・トラックに指定しました。
協和キリンとMEIは2020年4月にzandelisibのグローバルライセンスおよび共同開発・販売契約を締結しました。両社は米国では本剤を共同で開発・販売し、製品の売上収益はMEIが計上する一方で、米国以外の地域では協和キリンが本剤の独占的な販売権を有します。
現在進行中のzandelisibの臨床試験には、化学療法や抗CD20抗体を含む少なくとも2レジメンの全身療法が奏効しなかったFLとMZLの成人症例の計2群をそれぞれ対象としてzandelisibを単剤で評価する、第2相国際共同試験であるTIDAL(Trials of PI3K DeltA in Non-Hodgkin's Lymphoma)試験があります。主要評価項目は客観的奏効率です。本試験の結果とFDAとの協議を踏まえて、各試験群のデータは、迅速承認制度(21 CFR Part 314.500, Subpart H)に基づく迅速承認申請の根拠資料として、それぞれFDAに提出される予定です。
また協和キリンは、低悪性度B細胞性非ホジキンリンパ腫(小リンパ球性リンパ腫、リンパ形質細胞性リンパ腫、ワルデンストレームマクログロブリン血症を除く)を対象とした国内第2相臨床試験を実施中です。
- PI3Kδについて
- ホスファチジルイノシトール-3-キナーゼデルタ(PI3Kδ)はがん細胞での過剰発現が多くみられ、血液がんの増殖と生存に重要な役割を果たしています。Zandelisibは、PI3Kδアイソフォームに対して高い選択性を示すことから、他のPI3Kδ阻害剤とは異なる薬効を有しています。
- 濾胞性リンパ腫(FL)について
- 濾胞性リンパ腫(FL)は最も一般的な低悪性度リンパ腫であり、非ホジキンリンパ腫の約20~30%を占めます。B細胞から発生し、ほとんどの症例で慢性化してゆっくりと進行する傾向が見られます。FLと診断されるのは殆どが65歳であり、進行型の非ホジキンリンパ腫であるびまん性大細胞型B細胞リンパ腫(DLBCL)に転化することがあります。
