本ニュースリリースは、協和キリンと米国MEI Pharma, Inc.が5月13日(米国東海岸時間:日本時間5月14日)に発表した英文プレスリリースの内容を、協和キリンが日本語に翻訳、再構成し、発表しています。本ニュースリリースの正式言語は英語であり、その内容・解釈については英語が優先しますことをご留意下さい。協和キリン 英語リリース![]()
協和キリンとMEI Pharma社 濾胞性リンパ腫およびその他のB細胞悪性腫瘍を対象としたME-401の第1b相臨床試験の更新データに関する米国臨床腫瘍学会での発表について
- 再発または難治性の濾胞性リンパ腫被検者における全奏効率83%
- 解析したすべての患者サブセットにおいて、濾胞性リンパ腫の奏効期間は中央値に到達していない
- 本試験への参加中止理由として有害事象が占める割合は7%で概ね良好な忍容性を維持
協和キリン株式会社(本社:東京、代表取締役社長:宮本 昌志、以下「協和キリン」)とMEI Pharma, Inc. (本社:米国サンディエゴ、社長兼CEO:Daniel Gold 、以下「MEI」)は、B細胞悪性腫瘍を対象として現在開発中のホスファチジルイノシトール3-キナーゼデルタ(PI3Kδ)阻害剤ME-401第 1b 相試験で得られた最新のデータを米国臨床腫瘍学会(ASCO)2020年バーチャルサイエンティフィックプログラム(5月29日~31日)でのポスター発表することをお知らせします。本試験は、間歇投与スケジュールによる経口投与で、対象疾患(再発または難治性の濾胞性リンパ腫)の患者さん(n=36)において、良好な忍容性および83%の全奏効率を示しました。これら結果の詳細は本学会にて紹介される予定です。
試験データ概要
- 全奏効率は、解析した濾胞性リンパ腫患者サブセット(これまでの治療歴(1レジメンまたは2レジメン以上)または治療群(単剤療法またはリツキシマブとの併用))において76%~89%でした。
- すべての濾胞性リンパ腫の被験者において、解析したすべての患者サブセット(これまでの治療歴(1レジメンまたは2レジメン以上)や治療群(単剤療法またはリツキシマブとの併用)、腫瘍の大きさ(5cm未満または5cm以上))のいずれにおいても奏効期間は中央値に到達しておらず、持続的な奏効(追跡期間中央値:13.2カ月:範囲:3.0~27.6)が認められました。
- 間歇投与スケジュールで治療をうけた全被験検者(n=57)のうち、特に注目すべき有害事象(AESI)が7件報告されましたが、第3サイクル以降はグレード3以上のAESIは報告されませんでした。4名(7%)の患者は有害事象により治療を中止しました。報告されたAESIの内訳は下痢(2件)、大腸炎(2件)、ALT/AST値異常(1件)、発疹(1件)、非感染性肺炎(1件)でした。
ASCO バーチャルサイエンティフィックプログラムで発表するポスターの演題は「Tolerability and Durable Responses of the PI3Kδ Inhibitor ME-401 Administered on an Intermittent Schedule in Relapsed/Refractory (R/R) Follicular Lymphoma (FL) and Other B-cell Malignancies(和訳;再発または難治性(R / R)の濾胞性リンパ腫(FL)およびその他のB細胞悪性腫瘍を対象とした間歇投与スケジュールにおけるPI3Kδ阻害剤ME-401の忍容性および持続的奏効)」です。2020 年 5 月 29 日午前 8 時 00 分(米国東部標準時)から学会ホームページhttps://meetings.asco.org/am/virtual-program![]() でのオンライン閲覧が可能です。また、MEIのウェブサイトからポスターのダウンロードも行えます。https://investor.meipharma.com/ASCO-2020-ME401
でのオンライン閲覧が可能です。また、MEIのウェブサイトからポスターのダウンロードも行えます。https://investor.meipharma.com/ASCO-2020-ME401![]()
また、別途実施されている本剤の第2相臨床試験であるTIDAL試験(Trials of PI3K DeltA in Non-Hodgkin's Lymphoma)でも、再発または難治性の濾胞性リンパ腫の患者さんを対象としています。その結果は米国食品医薬品局(FDA)により迅速承認(accelerated approval)される際の主要な根拠資料となる予定です。
なお、ME-401はまだいずれの国・地域においても承認・販売されておらず、濾胞性リンパ腫やその他のB細胞悪性腫瘍に対する安全性や有効性は確立していません。
ME-401 第1b相臨床試験について
現在進行中の第1b相臨床試験は、再発または難治性のB細胞悪性腫瘍患者さんを対象に、ME-401の単剤療法および他の治療法との併用療法を評価する多群非盲検第1b相用量漸増・拡大試験です。今回報告するのは、最初に60mgを1日1回、28日間投与するサイクルを2回行った後、次のサイクルからは28日間のうち最初の7日間のみ1日1回投与する、間歇投与スケジュールで治療した被検者に関するデータです。これまでに57人の被検者が試験に参加し、内訳は再発/難治性の濾胞性リンパ腫36例、再発/難治性の慢性リンパ性白血病(CLL)10例、その他のB細胞悪性腫瘍11例となっています。
再発/難治性の濾胞性リンパ腫36例における全奏効率(Overall Response)は83%で、うち22%が完全奏効(Complete Response)を得られました。全奏効率は、ME-401単剤投与群の17例で76%、ME-401とリツキシマブの併用投与群19例で89%でした。評価可能なCLL患者9例の全奏効率は89%でした。
この表はスクロールしてご覧いただけます
| Diagnosis | Evaluable Subjects N |
ORR N (%) |
|---|---|---|
| FL By treatment group ME-401 monotherapy ME-401 + rituximab By prior lines of therapy 1 prior ≥ 2 prior |
36 17 19 16 20 |
30 (83%) 13 (76%) 17 (89%) 13 (81%) 17 (85%) |
| CLL/SLL By treatment group ME-401 monotherapy ME-401 + rituximab |
9 3 6 |
8 (89%) 3 (100%) 5 (83%) |
濾胞性リンパ腫例の被験者における追跡期間中央値は13.2ヶ月(範囲:3.0~27.6)で、奏効期間の中央値にまだ到達していません。解析された患者サブセット(これまでの治療歴(1レジメンまたは2レジメン以上)や治療群(単剤療法またはリツキシマブとの併用)、または腫瘍の大きさ(5cm未満または5cm以上))にかかわらず、本剤の効果は持続的であることが示唆されています。
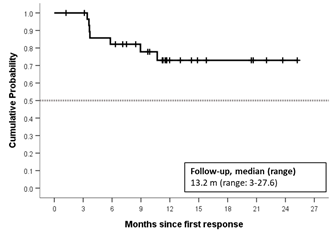
濾胞性リンパ腫(N=30)
ME-401の忍容性は概ね良好で、薬剤関連のグレード3のAESIの発生率は、下痢3.5%(2/57)、大腸炎3.5%(2/57)、発疹1.8%(1/57)、ALT/AST値上昇1.8%(1/57)、非感染性肺炎1.8%(1/57)でした。間歇投与された患者に関しては、第3サイクル以降にグレード3以上のAESIは報告されておらず、有害事象による試験からの離脱率は7%(4/57)でした。グレード3のALT/AST値上昇は単独で発生せず、また一過性であり、すべてグレード3の下痢または発疹とともに生じました。
ME-401 について
ME-401 は現在開発中の経口 PI3Kδ 阻害剤です。PI3Kδは血液がん細胞の増殖や生存に重要な役割を果たします。ME-401 は PI3Kδ のアイソフォームに対して高い選択性を示し、他の PI3Kδ 阻害剤とは異なる医薬品特性を有 しています。本剤は様々な B 細胞悪性腫瘍に対する臨床的な評価が行われており、米国 FDA は最近本剤をファスト・ トラックに指定しました。
MEI は、化学療法および抗 CD20 抗体を含む少なくとも 2 回の全身治療が奏功しなかった濾胞性リンパ腫を対象とした ME-401 単剤の有効性、安全性および忍容性を評価する第 2 相試験を現在実施しています。その結果は米国 食品医薬品局(FDA)により迅速承認(accelerated approval)される際の主要な根拠資料となる予定です。
また米国では B 細胞悪性腫瘍を対象に、ME-401 の単剤療法ならびにリツキシマブまたはザヌブルチニブとの併用療法を評価する第 1b 相試験も進行中であり、日本では協和キリンが低悪性度 B 細胞悪性腫瘍を対象とした単剤療法の第 1 相試験を 2019 年に開始しています。
MEI と協和キリンは、2020 年 4 月に、ME-401 のグローバルライセンス、開発・販売契約を締結しました。MEI と協和キリンは、ME-401 を米国で共同開発し、共同プロモーションを行います。協和キリンは、米国外での独占的な販売権を有しています。
